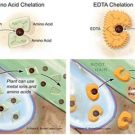
1. Giới thiệu các loại phức Chelate, hợp chất hóa học tạo phức Chelate
Chelate là phức chất vòng càng giữa các hợp chất hữu cơ dẫn xuất từ amino polycacboxylic axit với các ion kim loại.

1.1. Các dạng phức Chelate
Các dạng tồn tại của trung, vi lượng chelate thường ở hai dạng chủ yếu sau:
– EDTA viết tắt từ chữ: Ethylen Diamin Tetraacetic Axit và
– EDDHA, viết tắt từ chữ: Ethylene Diamin Di(o-Hydroxyphenylacetic) Axit, ngoài hai dạng trên đôi khi còn ở dạng:
– EHPG viết tắt từ chữ: (N,N’-Ethylenebis-2-(o-HydroxyPhenyl) Glycine) một dạng chiết xuất từ Amino axit.
1.2. Các hợp chất hữu cơ dẫn xuất từ amino Polycacboxylic axit
-
NTA – Nitrilo Triaxetic Axit

-
EDTA – Etylen Diamino Tetraaxetic Axit.
– Etylen Diamino Tetraxetic Axit (EDTA): H4Y
.jpg)
(H4Y tan kém trong nước, nên khi chuẩn bị dung dịch khó khăn)
– Dinatri etylen diamino tetra axit: Na2H2Y
.jpg)
(Na2H2Y dễ tan hơn trong nước hơn H4Y)
Để phản ứng xảy ra được dễ dàng người ta thường dùng Na2H2Y làm dung dịch tạo phức. Vì vậy để thuận tiện cho việc gọi tên ta quy ước H4Y và NaH2Y đều gọi chung là EDTA.
-
Ethylene Diamine-N,N’-bis (2-Hydroxyphenylacetic) Axit: EDDHA

EDDHA được biết với tên thông thường là Ethylene Diamine Di (o-hydroxy phenyl acetic) Axit, hoặc EHPG [N,N’- Ethylenebis-2-(o-Hydroxy Phenyl) Glycine]. Nó có những liên kết mạnh giữa những nhóm phenolic và các kim loại (đặc biệt là Fe(III), Zn, Mn). Những liên kết này mạnh hơn nhiều những liên kết thuần tuý của Cacboxylic chelates của EDTA.
-
DTPA – Diethylene Triamine Pentaacetic Acid
Là hoá chất đắt tiền, được sử dụng nhiều trong lĩnh vực dược để sản xuất các thuốc uống có chứa vi lượng: Zinc-DTPA, Canxi-DTPA…
Trong khuôn khổ bài viết này chúng ta chỉ nghiên cứu về phức EDTA Chelate, phức điển hình được làm nguyên liệu trong sản xuất phân bón và pha chế dung dịch dinh dưỡng cây trồng thủy canh.
1.3. Tìm hiểu về EDTA, EDTA là gì?, tính chất vật lý hóa học của EDTA
– EDTA là từ viết tắt của EthyleneDiamineTetraacetic Acid. Đây là một axít hữu cơ mạnh (hơn 1.000 lần so với axít acetic), được tổng hợp vào năm 1935 bởi nhà bác học F. Munz.
– EDTA và các muối của nó thường ở dạng tinh thể màu trắng hoặc bột, không bay hơi và có độ tan cao trong nước.

– EDTA được tổng hợp từ ethylenediamine (C2H4(NH2)2), formol (HCHO) và gốc cyanide (HCN hoặc NaCN).
– Các sản phẩm thương mại thường ở dạng muối như là CaNa2EDTA, Na2EDTA, Na4EDTA, NaFeEDTA,…
– EDTA phân hủy (cháy khét) ở nhiệt độ > 160oC.
2. Cơ sở lý thuyết tạo phức trung, vi lượng dạng EDTA Chelate
2.1. Sự tạo phức của EDTA và ion kim loại
– EDTA trong nước là axit yếu, phân ly theo 4 nấc có các hằng số pK1 = 2,0; pK2 = 2,67; pK3 = 6,16; pK4 = 10,26.
– Trong dung dịch EDTA phân ly theo phương trình: Na2H2Y → 2Na+ + H2Y2-
Anion H2Y2- tạo phức với hầu hết các cation kim loại:
M+ + H2Y2- = MY3- + 2H+ (kim loại hóa trị I)
M2+ + H2Y2- = MY2- + 2H+ (kim loại hóa trị II)
M3+ + H2Y2- = MY– + 2H+ (kim loại hóa trị III)
M4+ + H2Y2- = MY + 2H+ (kim loại hóa trị IV)
Phản ứng tổng quát của EDTA với ion kim loại: Mn+ + H2Y2- = MY(n-4) + 2H+
Ta nhận thấy:
– Các ion kim loại không phân biệt hoá trị tạo phức với EDTA theo mol là 1:1
2.2. Mô tả giải thích quá trình phản ứng của Cation kim loại với EDTA
– Sự tạo thành phức của kim loại với Amoniac (NH3): phân tử NH3 kết hợp với các ion kim loại bằng những liên kết cho nhận giữa cặp electron tự do của N với ion kim loại tạo thành những chất tan trong dung dịch.

– Đối với Ethylenediamin hai phân tử amoniac sẽ cùng liên kết với ion kim loại. Mỗi một nitơ sẽ cho nhận 1 cặp điện tử, như vậy sẽ hình thành một liên kết đồng hoá trị với ion kim loại.

 – Đối với EDTA các hidro được thay thế bởi Ion Axetat. Một trong những oxi trong Axetat lại có khả năng hình thành mối liên kết khác với ion kim loại (Trong ion Axetat có hai nguyên tử oxi với bốn cặp điện tử, nhưng chỉ có một ion duy nhất có thể hướng về phía ion kim loại, và ion axetat sẽ mất đi một hidro để hình thành liên kết C-N).
– Đối với EDTA các hidro được thay thế bởi Ion Axetat. Một trong những oxi trong Axetat lại có khả năng hình thành mối liên kết khác với ion kim loại (Trong ion Axetat có hai nguyên tử oxi với bốn cặp điện tử, nhưng chỉ có một ion duy nhất có thể hướng về phía ion kim loại, và ion axetat sẽ mất đi một hidro để hình thành liên kết C-N).

Cấu trúc phức chelate

Độ bền của các phức chelate kim loại phụ thuộc vào pH dung dịch và cấu trúc electron của ion trung tâm.
2.3. Ảnh hưởng của pH môi trường đối với phản ứng giữa ion kim loại với EDTA
Trong phản ứng tạo phức luôn đẩy ra 2 ion H+, do vậy độ bền của phức chịu sự ảnh hưởng của pH môi trường là khá lớn.
– Hằng số bền của phức (Kb):
Trong dung dịch phức MY phân ly theo phương trình: MY(n-4) → Mn+ + Y4-
.jpg)
Trong đó [Y4-] phụ thuộc vào pH môi trường (nồng độ H+) vì:

– Vì vậy khả năng tạo phức với kim loại (hằng số bền của phức Kb) phụ thuộc vào pH của dung dịch, chẳng hạn như Ca2+ và Mg2+ yêu cầu pH khoảng 10. Mặt khác, sự tạo phức với các kim loại còn phụ thuộc vào hằng số hình thành phức, hằng số càng cao thì khả năng tạo phức càng cao.
– EDTA di chuyển vào trong đất và tạo phức với các kim loại vết cũng như là các kim loại kiềm thổ (Na+, K+, Ca2+,…), từ đó làm tăng độ hòa tan của kim loại. Đặc biệt là trong đất phèn, EDTA sẽ tạo phức kẹp (chelate) Fe-EDTA từ đó làm giảm quá trình hoạt động của Fe3+. Trong môi trường kiềm, EDTA lại tạo phức chủ yếu với Ca2+ và Mg2+ tạo thành CaMg-EDTA làm giảm độ cứng của nước.
2.4. Một số phức EDTA chelate, tính chất hóa lý và độ bền của phức
Một số phức EDTA chelate ứng dụng làm dinh dưỡng cây trồng sau:
-
Phức Sắt EDTA Chelate

Tên gọi tắt: EDTA-Fe-13
Tên gọi đầy đủ: Ethylenediaminetetraacetic acid, ferric sodium complex
Công thức hóa học: EDTA-FeNa.3H2O (C10H12FeN2NaO8)
Khối lượng phân tử: 421,1
% Khối lượng kim loại dạng chelate: 13,12
Độ tan trong nước: 99,98%
pH (nồng độ 1%): 4-6,5
-
Phức Mangan EDTA Chelate

Tên gọi tắt: EDTA-Mn-13
Tên gọi đầy đủ: Ethylenediaminetetraacetic acid, manganese disodium complex
Công thức hóa học: EDTA-MnNa2 (C10H12N2O8MnNa2)
Khối lượng phân tử: 389,1
% Khối lượng kim loại dạng chelate: 13
Độ tan trong nước: 99,97%
pH (nồng độ 1%): 6-7
-
Phức Đồng EDTA Chelate

Tên gọi tắt: EDTA-Cu-15
Tên gọi đầy đủ: Ethylenediaminetetraacetic acid, copper disodium complex
Công thức hóa học: EDTA-CuNa2 (C10H12N2O8CuNa2)
Khối lượng phân tử: 397,7
% Khối lượng kim loại dạng chelate: 15
Độ tan trong nước: 99,9%
pH (nồng độ 1%): 6-7
-
Phức Kẽm EDTA Chelate

Tên gọi tắt: EDTA-Zn-15
Tên gọi đầy đủ: Ethylenediaminetetraacetic acid, zinc disodium complex
Công thức hóa học: EDTA-ZnNa2 (C10H12N2O8ZnNa2)
Khối lượng phân tử: 399,6
% Khối lượng kim loại dạng chelate: 15
Độ tan trong nước: 99,97%
pH (nồng độ 1%): 6-7
-
Phức Magie EDTA Chelate

Tên gọi tắt: EDTA-Mg-6
Tên gọi đầy đủ: Ethylenediaminetetraacetic acid, magnesium disodium complex
Công thức hóa học: EDTA-MgNa2 (C10H12N2O8MgNa2)
Khối lượng phân tử: 358.52
% Khối lượng kim loại dạng chelate: 6
Độ tan trong nước: 99,95%
pH (nồng độ 1%): 6-7
-
Phức Canxi EDTA Chelate

Tên gọi tắt: EDTA-Ca-10
Tên gọi đầy đủ: Ethylenediaminetetraacetic acid, calcium disodium complex
Công thức hóa học: EDTA-CaNa2.2H2O (C10H12N2O8CaNa2.2H2O)
Khối lượng phân tử: 410.13
% Khối lượng kim loại dạng chelate: 10
Độ tan trong nước: 99,98%
pH (nồng độ 1%): 6-7
3. Ứng dụng của phức Chelate trong sản xuất phân bón và dung dịch thủy canh.
3.1 Ứng dụng phức Chelate trong sản xuất phân bón lá, dung dịch thủy canh, phân bón dùng trong công nghệ tưới nhỏ giọt.
Dung dịch thủy canh, phân bón tưới nhỏ giọt cần sử dụng các chất dinh dưỡng đa lượng tan hoàn toàn trong nước như: KNO3, KH2PO4 (MKP), K2SO4, CaNO3… dinh dưỡng trung, vi lượng dạng chelate (tan hoàn toàn) như: CaEDTA, MgEDTA, CuEDTA, ZnEDTA, FeEDTA, MnEDTA… (nếu sử dụng trung vi lượng dạng vô cơ như FeSO4, CuSO4… bắt buộc phải dùng Na2EDTA để trung hòa hoàn toàn trước khi phối trộn với dinh dưỡng đa lượng.
Đối với phân bón lá muốn tăng hiệu suất sử dụng, tăng nhanh thời gian phát huy hiệu quả của sản phẩm chúng ta có thể một số chất điều hòa sinh trưởng bằng cách thêm các nguyên liệu GA3, NAA, Compound Sodium Nitrophenolate… chất bám dính.
Một số sản phẩm phân bón lá, dung dịch thủy canh, phân bón tưới nhỏ giọt có sử dụng trung, vi lượng chelate
-
Dung dịch thủy canh Tháp Xanh chuyên dùng cho rau ăn lá

Hàm lượng dinh dưỡng: N(NO3–): 176ppm; N (NH4+): 15ppm; P2O5: 55ppm; K2O: 205ppm; Mg: 45ppm; Ca: 182ppm; S: 77ppm; Fe: 5ppm; Zn: 0,1ppm; B: 0,5ppm; Mn: 0,5ppm; Cu: 0,1ppm; Mo: 0,05ppm.
-
Phân bón cho hệ thống tưới nhỏ giọt Hakaphos của hãng BEHN MEYER

-
Phân bón lá đầu trâu

Thành phần: Đạm (N), Lân (P2O5), Kali (K2O), lưu huỳnh (S), magiê (Mg), canxi (Ca), kẽm (Zn), sắt (Fe), đồng (Cu), mangan (Mn), bo (B), molypden (Mo), gibberellin, αNAA, bNOA…
3.2. Ứng dụng trong các sản phẩm phân hỗn hợp NPK cao cấp, phân bón gốc công nghệ cao (Siêu đạm, Siêu Urea, Đạm tan chậm, đạm bọc vi lượng, Đạm Urea + TE…)
Khác với phân bón lá, dung dịch thủy canh và phân bón tưới nhỏ giọt – phân bón gốc thông thường không đòi hỏi khắt khe về độ hòa tan và hình thức của sản phẩm, vì vậy các nhà sản xuất thường lựa chọn một số nguyên liệu cung cấp trung, vi lượng vô cơ với giá thành hợp lý.
-
Ưu nhược điểm của trung, vi lượng dạng Chalate ứng dụng sản xuất phân bón gốc:
+ Ưu điểm: Trung, vi lượng dạng Chelate tan hoàn toàn trong nước (99,5 – 99,9%, pH 4 – 7), hiệu quả cao gấp hằng chục đến hàng trăm lần vi lượng vô cơ thông thường, lượng dùng rất ít, không chứa gốc Clo, không ăn mòn thiết bị sản xuất, là hợp chất hữu cơ nên thân thiện với con người và động, thực vật.
+ Nhược điểm: Trung, vi lượng dạng Chelate có giá đắt hơn nhiều lần (từ 5 – 20 lần) vi lượng vô cơ thông thường, lượng dùng ít nên khó phối trộn đồng đều trong hỗn hợp thành phẩm.
Vì vậy các sản phẩm phân bón gốc thông thường nhà sản xuất thường chủ yếu sử dụng trung vi lượng dạng gốc vô cơ như: CaCl2, MgSO4.H2O, CuSO5.H2O, ZnSO4.H2O, MnSO4.H2O… giá thành hợp lý, dễ phối trộn. Đối với gốc chelate chỉ sử dụng sắt chelate (FeEDTA) vì sắt vô cơ (FeSO4) rất dễ tạo kết tủa và không có tác dụng trong điều kiện pH thông thường.
Đối với các sản phẩm cao cấp như: Đạm Vi lượng, Siêu đạm, Đạm Urea + TE, Đạm tan chậm, NPK cao cấp… đòi hỏi về hình thức sản phẩm, độ tan tốt và lượng phối trộn thêm trung, vi lượng ít mà vẫn đảm bảo hiệu quả trên cây trồng – Yêu cầu gần như bắt buộc là sử dụng các trung, vi lượng dạng chelate.
-
Một số sản phẩm cao cấp sử dụng trung, vi lượng dạng chelate.

Đạm Urea N46TE của công ty Sitto Việt Nam: N: 46%; B: 4,8 ppm; Fe: 5 ppm; Mn: 8 ppm; Zn: 12,5 ppm
Đạm vàng Tiến Nông: N: 45%; B: 100ppm; Zn: 50ppm
Siêu đạm Tiến Nông: N: 31%; CaO: 1,5%; MgO: 1,0%; S: 6,
3.3. Một số lưu ý khi sử dụng trung, vi lượng trong sản xuất phân bón.
– Đối với dung dịch thủy canh, phân bón lá, phân bón tưới nhỏ giọt, bắt buộc phải sử dụng vi lượng dạng chelate hoặc được hoạt hóa theo công nghệ chelate, sử dụng các nguyên liệu có độ tinh khiết cao, tan hoàn toàn trong nước.
– Đối với phân bón gốc thông thường nên sử dụng các loại trung vi lượng dạng vô cơ có sẵn trong tự nhiên (Quặng Secpentin, CaCO3, Dolomite…), các vi lượng gốc vô cơ (CaCl2, MgSO4.H2O, CuSO5.H2O, ZnSO4.H2O, MnSO4.H2O…), không nên sử dụng sắt gốc vô cơ (vì Fe2+ rất oxy hóa thành Fe3+, sau đó kết tủa).
– Vì hiệu quả của trung, vi lượng dạng chelate hiệu quả gấp hằng chục đến hàng trăm lần vi lượng dạng vô cơ nên cũng chỉ cần lượng dùng nhỏ tương đương để đảm bảo hiệu quả và giá thành thành phẩm sản xuất (VD: NPK + TE vô cơ có hàm lượng 100ppm Zn thì NPK + TE chelate chỉ cần 10ppm Zn).
– Vì sử dụng lượng rất nhỏ (vài trăm gam – vài kg/tấn thành phẩm phân bón gốc) nên đòi hỏi trung, vi lượng bổ sung phải được phối trộn đều nhiều cấp hoặc hòa tan trong nước trong quá trình tạo hạt để đảm bảo độ đồng đều của thành phẩm. Đối với các sản phẩm Đạm Urea vi lượng, Siêu đạm, Phân bón công nghệ tháp cao, công nghệ hơi nước, công nghệ hóa lỏng Urea… chúng ta nên bổ sung trực tiếp vào dịch Urea trước khi tạo hạt hoặc bọc vi lượng bên ngoài sau khi tạo hạt. Nhiệt độ dung dịch chứa trung, vi lượng – nhiệt độ sấy sản phẩm không nên vượt quá 160oC.
Để tính toán công thức phân bón NPK có chứa vi lượng (NPK + TE), bạn đọc có thể tham khảo bài viết Công nghệ sản xuất phân bón hỗn hợp NPK: Phần 3 – Cách tính công thức hoặc liên hệ với Admin để được trợ giúp.
Nguồn: Admin